W środę planowana jest pierwsza dostawa do Polski szczepionki przeciw COVID-19 od koncernu Johnson & Johnson. Do uzyskania odporności wystarczy jeden domięśniowy zastrzyk.
Szczepionka o nazwie COVID-19 Vaccine Janssen to czwarty dopuszczony w Unii Europejskiej preparat, jego dostawy do krajów członkowskich ruszyły w poniedziałek. Szczepionka koncernu Johnson & Johnson jako jedyna wymaga podania tylko jednej dawki. Szczepionki od firm Pfizer/BioNTech, Moderna i AstraZeneca są dwudawkowe.
Preparat, opracowany przez Janssen Pharmaceutica NV, firmę z pionu farmaceutycznego Johnson & Johnson, będzie w Polsce – jak zapowiada rząd – stosowany m.in. u osób, które samodzielnie nie mogą dotrzeć do punktów szczepień.
Szczepionka COVID-19 Vaccine Janssen podawana jest u osób powyżej 18 lat, wyłącznie we wstrzyknięciu domięśniowym, preferowanym miejscem jest górna część ramienia. Zgodnie z charakterystyką produktu leczniczego, ochrona rozpoczyna się około 14 dni po szczepieniu.
Szczepionka powoduje, że układ odpornościowy wytwarza przeciwciała i wyspecjalizowane białe krwinki, które działają przeciwko wirusowi, zapewniając w ten sposób ochronę przed COVID-19.
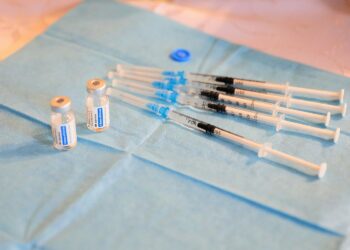
Preparat dystrybuowany jest w fiolkach, które zawierają pięć dawek po 0,5 ml. Szklana fiolka ma korek z gumy, aluminiowy kapsel i niebieską plastikową nakładkę.
Nieotwarta fiolka zachowuje ważność przez dwa lata podczas przechowywania w temperaturze od -25°C do -15°C. Po wyjęciu z zamrażarki, nieotwarta szczepionka może być przechowywana w lodówce w temperaturze od 2°C do 8°C, w miejscu chronionym przed światłem, jednorazowo przez okres do trzech miesięcy. W temperaturze od 9°C do 25°C nieotwarta szczepionka COVID-19 Vaccine Janssen jest stabilna przez 12 godzin.
Po pierwszym przekłuciu fiolki, produkt może być przechowywany w temperaturze 2°C-8°C przez maksymalnie 6 godzin lub pozostawać w temperaturze pokojowej (maksymalnie 25°C) do 3 godzin od napoczęcia.
Szczepionka opiera się na niezdolnym do replikacji adenowirusie – Ad26. Jest on nośnikiem materiału genetycznego, pod wpływem którego komórki zaszczepionej osoby zaczynają wytwarzać białko wypustkowe (białko kolca, białko S) wirusa SARS-CoV-2 powodującego COVID-19. Reagując na białko wirusa, organizm wytwarza odporność.

W USA wstrzymano szczepienia z użyciem preparatu J&J
We wtorek Amerykańska Agencja Żywności i Leków (FDA) oraz Centra Kontroli i Prewencji Chorób (CDC) zaleciły wstrzymanie w USA szczepień z użyciem preparatu z uwagi na wystąpienie sześciu przypadków rzadkich zakrzepów krwi wśród 6,8 mln zaszczepionych osób. W związku z sygnałami, jeszcze w zeszłym tygodniu, Europejska Agencja Leków (EMA) rozpoczęła działania zmierzające do oceny zgłoszonych zdarzeń zatorowych i zakrzepowych u osób, które otrzymały tę szczepionkę przeciw COVID-19. Dziś (środa) odbędzie się posiedzenie Europejskiej Agencji Leków (EMA) w sprawie szczepionki Johnson & Johnson.
Światowa Organizacja Zdrowia (WHO) poinformowała we wtorek agencję Reutera, że zajmie stanowisko ws. szczepionki firmy Johnson & Johnson przeciw COVID-19, gdy otrzyma informacje o wynikach analiz Europejskiej Agencji Leków (EMA) i amerykańskiej Agencji Żywności i Leków (FDA) dotyczących tego preparatu. WHO poinformowała w mailu do Reutera, że monitoruje również bazy danych na świecie, by wykryć ewentualne szkodliwe reakcje na podanie szczepionki Johnson&Johnson, w związku wystąpieniem zakrzepów krwi u osób szczepionych. Organizacja nie sprecyzowała, jak długo potrwa jej analiza bezpieczeństwa i ewentualnych skutków ubocznych stosowania preparatu J&J.
Wcześniej we wtorek FDA i amerykańskie Centra Kontroli i Prewencji Chorób (CDC) zaleciły wstrzymanie podawania szczepionki J&J ze względu na wystąpienie sześciu przypadków zakrzepów krwi wśród 6,8 mln zaszczepionych osób. Obie agencje podały, że analizują wszystkie te przypadki „rzadkiego i ciężkiego typu skrzepu krwi”.
Szczepionki Johnson&Johnson już w Polsce. Kto je otrzyma?
Wiceminister zdrowia Waldemar Kraska pytany był w środę w Polsat News o plan dystrybucji i podawania szczepionki J&J oraz czy ta informacja z USA jakoś wpływa na to, co dzieje się w Europie i w Polsce.
– Rzeczywiście ta informacja jest dość niepokojąca, że Stany Zjednoczone wstrzymały tę dystrybucję szczepionki firmy Johnson & Johnson. Wiemy, że tych szczepionek w Stanach Zjednoczonych zostało podanych prawie siedem milionów. Sześć objawów wystąpiło niepożądanych. To jest można powiedzieć, nie tylko rzadkie zdarzenie, ale ultrarzadkie zdarzenie. Sześć osób miało zespoły pozakrzepowe, w tym jedna osoba niestety zmarła – zaznaczył wiceminister zdrowia.
Poinformował, że w środę odbędzie się posiedzenie Europejskiej Agencji Leków (EMA), która będzie tę sytuację analizowała.
– Jaka będzie decyzja (Agencji), taką decyzję podejmiemy my, jeśli chodzi o szczepienie Polaków tą szczepionką – podkreślił Kraska.
Na pytanie, gdzie szczepionki tej firmy, które dotarły w środę do Polski w ilości 120 tys. dawek miały być podawane Kraska odparł, że miały one trafić do punktów wyjazdowych, które jeżdżą i szczepią pacjentów w miejscu ich zamieszkania.
– Czyli pacjentów, którzy są obłożnie chorzy, są osobami, które nie mogą się osobiście stawić w punkcie szczepień. Taka była idea, bo jest to szczepionka jednodawkowa, czyli taki jeden wyjazd już praktycznie takiego pacjenta będzie zabezpieczał po podaniu tej jednej dawki. Ale w tej chwili czekamy na informacje z Europejskiej Agencji Leków – zaznaczył wiceszef MZ.
Wcześniej podobne, choć również bardzo rzadkie przypadki zakrzepów zostały zaobserwowane przy innych szczepionkach tego samego typu, tj. AstraZeneki oraz Sputnika V. Są to tzw. szczepionki wektorowe, używające sztucznie tworzonych cząstek niegroźnych wirusów (adenowirusów) zawierających białko szczytowe SARS-CoV-2. Zdecydowana większość przypadków zakrzepów wystąpiła u kobiet poniżej 50. roku życia.